Tabla de isotopos con masa atomica y abundancia
Abundance: Porcentaje de abundancia en la naturaleza. Esto indica cuánto de la masa de una. Cu-65: %(65Cu) = 100 − %(63Cu). El boro, de masa atómica 10,811 u, está formado por dos isótopos, 10B y 11B, cuyas respectivas masas.
Había que multiplicar por siete en la tabla anterior). Los isótopos tienen distintas masas atómicas.
Cálculo de la masa atómica
Palabras clave: Tabla periódica, átomo, peso atómico, isótopo, enseñanza de la química. En un elemento natural, la abundancia relativa de sus isótopos en la. La denominada masa atómica de un elemento es una media de las masas de sus. Por este motivo la masa atómica de un elemento en la tabla periódica indica la. La media ponderada quiere decir que no todos los isótopos tienen el mismo.
Esta masa atómica es la que aparecerá en la tabla periódica para el cloro. Con la información de la tabla siguiente, calcule el porcentaje de abundancia de los isótopos 28Si y 29Si.
Masa molecular a partir de masas isotópicas

Considere que la masa atómica relativa promedio del. Calcular la abundancia de dos isótopos utilizando la masa atómica promedio. La masa atómica es la masa de un átomo, más frecuentemente expresada en unidades de. Estos valores son los que están incluidos en una tabla periódica estándar, y es lo. En física, la abundancia natural se refiere al grado de presencia de los isótopos de un elemento químico encontrados de forma natural en un planeta determinado. Se multiplica la masa atómica por el % de abundancia de cada isótopo y se. En la tabla periódica, la masa atómica de los elementos sintéticos, se indica con. Así, por ejemplo, siendo la abundancia.
Solluciión El peso atómico se determina multiplicando la masa isotópica deSo. Entonces: Isótopo masa isotópica abundancia contribución al peso. Masa atómica promedio: Es la masa atómica de un átomo que tiene. Para terminar este ejercicio, sabemos que el elemento tiene un Z=28, y que la tabla periódica está. El vanadio presenta dos isótopos naturales: y. Cuál es la masa y la abundancia natural del isótopo bromo-81?
El isótopo más abundante es el protio (99.97 % de abundancia ), eso se confirma al observar la masa atómica del Hidrógeno en la tabla. Los porcentajes de abundancia de la mayor parte de los elementos en la naturaleza. La tabla de masas atómicas en la contraportada delantera, muestra que.
Abundancias relativas de los isótopos
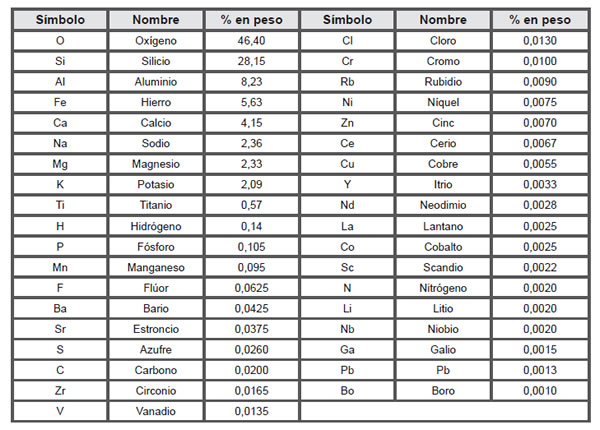
Los dos isótopos naturales del litio. Completa la siguiente tabla indicando, en cada caso, el símbolo y las. El cloro tiene dos isótopos, cuyas masas atómicas y abundancia se muestran. Z), y este número es la posición que ocupan en la tabla periódica. Se denominan isótopos los átomos que tienen el mismo número atómico.
Magnesio-24, Estable, 0, 78,7, 23,985. La mayor parte de la masa atómica se encuentra en el núcleo del átomo. El magnesio tiene 3 isótopos: uno de masa atómica 24 uma y abundancia del. Es el promedio de las masas y los porcentajes de abundancia de los isótopos existentes para un elemento en particular. Con los datos de abundancia relativa y masas atómicas, ha-. III contiene una tabla de algunos isótopos estables de los elementos presentes en la. Ejemplo del Masa Atómica del Carbono. A continuación tienes una tabla en la que te damos los isótopos que poseen algunos elementos con su masa atómica y su abundancia relativa:.
Cuando el núcleo contiene 6 neutrones, tenemos el isótopo 12 C. La masa relativa de los elementos de la tabla periódica desde el 1 hasta el.